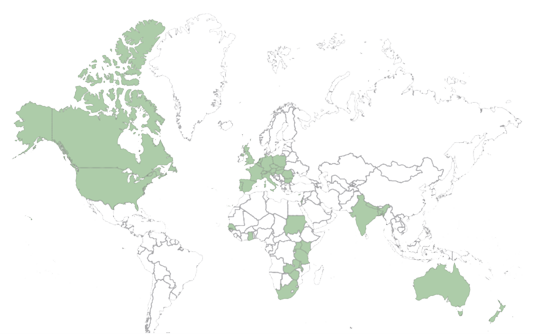
Num mundo internacional com estudos globais, sabemos como nos adaptar às necessidades locais.
Um percurso de 16 anos que oferece o melhor dos nossos estudos clínicos
Para falar da León Research, temos de falar da Rocío, a sua fundadora.
Depois de começar como CRA para uma multinacional americana, tornei-me freelancer e aumentando os meus contactos pouco a pouco Em 2007, decidi lançar a León Research, uma empresa CRO e de consultoria farmacêutica. Pouco tempo depois, Alfonso García, meu irmão e atual CEO da empresa, juntou-se à equipa.
Começámos com 3 pessoas e hoje somos uma equipa de 45. Começámos em Espanha e hoje temos escritórios em Itália e Portugal. Não sabemos o dia a dia, mas continuamos a aumentar a nossa grande família e vamos continuar assim, enquanto mantivermos o entusiasmo e a vontade de oferecer o nosso melhor serviço aos clientes, que o futuro nos traz, para além da ciência e os doentes.
Rocío.

A nossa CRO estará sempre ao seu lado, colaborando em todas as fases do processo

Alfonso García Cañamaque
CEO

Rocío García Cañamaque
Founder
Uma CRO com valores definidos

Honestidade:
Poder dar aos outros o que gostaríamos de receber: apoio, ajuda, fidelidade, confiança, tolerância e compreensão.
Flexibilidade:
É autoexigência nossa ter a flexibilidade de adaptarmos os nossos serviços aos requisitos do cliente, no âmbito do GCP/ICH e dos nossos próprios SOPs e sistema de qualidade.

Criatividade:
Colocamos todos os sistemas inteligentes de informação e de gestão ao serviço dos nossos clientes e utilizamos a criatividade como a ferramenta que pode transformar um projeto num sucesso.
Como trabalhamos na Leon Research:

Experiência
Isto é o que temos desenvolvido na Leon Research
16 anos de experiência e o nosso trabalho em mais de 350 projetos garantem-nos a competência que temos hoje.
Projetos com medicamentos em investigação: fases I, II e III
Projetos com dispositivos médicos
Projetos com medicamentos comercializados
Projetos com suplementos alimentares e produtos cosméticos
Possuímos certificação ISO 9001:2015
A nossa atividade baseia-se num sistema de gestão da qualidade certificado pela norma ISO 9001. Seguimos as Boas Práticas Clínicas (BPC) e o procedimento adequado (SOP) para cada estudo. Política de qualidade da Leon Research

Descubra estas publicações sobre Leon Research
Procura uma CRO-Contract Research Organization em Espanha, Itália e Portugal?
Não hesite em contatar-nos e dizer-nos o que precisa
Somos membros das seguintes associações




Temos o selo PME inovadora que reconhece a nossa intensa atividade de I+D+i