La nueva regulación de los ensayos clínicos en España
La nueva regulación de los ensayos clínicos
Apúntate esta fecha “Mayo de 2016” ¡Hacía tiempo que esperábamos esto y por fin ha llegado! Una nueva regulación de los ensayos clínicos para acortar los plazos y aumentar la transparencia y las garantías de los pacientes.
El pasado diciembre se aprobó el Real Decreto 1090/2015 (que sustituye al Real Decreto 223/2004) por el que se regulan los ensayos clínicos con medicamentos, los comités de ética de la investigación con medicamentos y el Registro Español de Estudios Clínicos y comenzará a aplicarse en mayo de 2016.
El principal objetivo es adaptar la legislación española para hacer viable la aplicación actual y futura del Reglamento (UE) n.º 536/2014 y desarrollar aquellos aspectos que el reglamento deja a la legislación nacional.
Surge ante el objetivo de mantener y mejorar la posición competitiva de España, ya que actualmente España participa en aproximadamente el 18% de los ensayos clínicos que se realizan en Europa, la mayor parte son multicéntricos y muchos de ellos multinacionales.
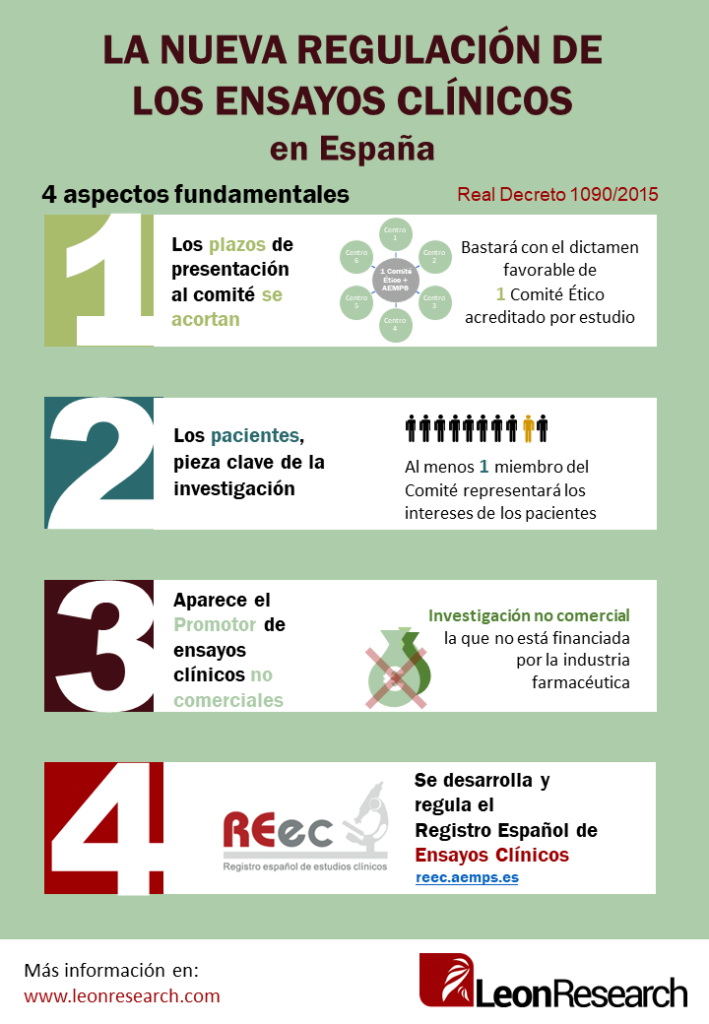
Estos son los cuatro aspectos fundamentales de los que trata el Real Decreto.
Los plazos de presentación se acortan
Un ensayo clínico con medicamento debe presentarse a los Comités Éticos y a la AEMPs (Agencia Española de Medicamentos y Productos Sanitarios). Con la nueva regulación, los trámites se simplifican, ya que sólo se tendrá que presentar a un Comité de Ética acreditado y obtener la autorización de la AEMPS; donde antes era necesario presentar y recibir la aprobación de tantos Comités Éticos como centros participantes en el ensayo.
Además, el proceso de negociación de la conformidad para realizar el ensayo en cada uno de los centros, ahora se podrá realizar paralelamente mientras se presenta al Comité y a la Agencia, lo que acortará también los plazos.
Los pacientes, pieza clave del proceso de investigación
El Comité Ético estará formado por un mínimo de 10 miembros, y será obligatoria la participación de por lo menos un miembro ajeno a la investigación, que representará los intereses de los pacientes. De esta forma se incluyen a los pacientes a participar en decisiones que les afectan directamente.
Aparece el promotor de ensayos clínicos no comerciales
El promotor de ensayos sin ánimo comercial fomentará la investigación no comercial, que es la que no está financiada por la industria farmacéutica. El decreto ofrece ciertas ventajas para este tipo de investigación no comercial como la exención de tasas y la no necesidad de presentar el seguro del ensayo hasta que no se reciba el dictamen favorable.
Se desarrolla y regula el REec (Registro Español de Ensayos Clínicos)
El Registro Español de Ensayos Clínicos surge para aumentar la transparencia y que se puedan consultar los ensayos clínicos autorizados en España y los centros en los que se realizan. Este decreto lo desarrolla en el artículo 47 y se puede encontrar en la siguiente dirección: https://reec.aemps.es.
Fuente:
http://www.aemps.gob.es/informa/notasPrensa/docs/2015/nota-prensa_04-12-2015-Ensayos-clinicos.pdf
https://www.boe.es/boe/dias/2015/12/24/pdfs/BOE-A-2015-14082.pdf